13. 효소
대부분의 생물학적 촉매는 효소라고 하는 단백질이다. 생물학적 촉매는 분자 골격 또는 분자 지지대로 그 내분에서 화학적 촉매 작용이 일어난다. 효소는 반응물에 결합하고 때때로 반응에 참여하기도 하지만, 이러한 참여는 효소를 영구하게 변화시키지 않는다. 이는 모든 촉매의 전형적으로 나타나는 특징으로 촉매는 반응 후에 화학적으로 반응 전과 정확하게 동일한 상태가 된다. 자유 에너지 감소반응은 자유에너지를 방출하지만, 촉매가 없다면 반응물과 생성물 사이의 에너지 장벽으로 인해 반응이 아주 느리게 일어날 것이다.
| 설탕 + H2O -> 포도당 + 과당 |
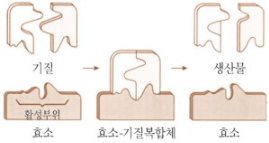
체내에서 이 반응은 소화의 일부분이다. 물이 풍부하게 존재하지만, 반응을 일으킬 수 있는 에너지의 유입이 없는 한 설탕 분자에서 포도당과 과당 사이의 공유결합을 끊기에 적절한 위치에 물의 H 원자와 -OH기가 결합하는 경우는 매우 드물 것이다. 에너지가 유입되면 설탕이 전이상태라고 불리는 활성화 상태에 놓일 수 있다. 설탕이 이러한 상태에 도달하기 위해 투입되는 에너지를 활성화 에너지라고 한다. 폭죽은 불을 붙이기 전에는 폭발하지 않지만, 활성화 에너지인 불이 폭죽 안의 분자에 영향을 미쳐 공기 중의 산소와 반응하게 하여 전이상태에 도달하면 폭발반응이 일어난다. 일반적으로 자유에너지 감소반응은 약간의 투입된 에너지에 의해 반응물이 에너지 장벽을 넘어선 후에만 진행된다. 따라서 에너지 장벽은 반응의 시작에 필요한 에너지양인 활성화 에너지에 해당한다. 만약 언덕에서 굴러 내려가는 공이 있다고 가정했을 때, 공은 언덕 위에 있을 때 많은 양의 위치에너지를 가지고 있다. 하지만, 공이 작은 구덩이에 빠져 있다면 자유에너지 감소반응이라 할지라도 언덕을 굴러 내려가지 못할 것이다. 공을 구르게 하려면 공을 구덩이 밖으로 밀어내기 위해 소량의 에너지가 필요하며 화학반응에서 활성화 에너지는 반응물을 전이상태 중간체라 부르는 불안정한 분자 형태로 바꾸는데 필요한 에너지이다. 전이상태 중간체는 반응물이나 생성물보다 더 많은 자유에너지를 가진다. 이들의 결합은 늘어나 있고 불안정하다. 반응에 따라 필요한 활성화 에너지양은 다르지만, 반응 전체의 자유에너지 변화와 비교하면 그 양은 대개 적다. 반응의 시작에 투입된 활성화 에너지는 반응의 내리막길 구간에 회수되며, 따라서 이것은 순 자유에너지 변화의 일부는 아니다. 인간의 체온에서 반응물은 이리저리 움직인다. 이 중 일부만 운동에너지가 에너지 장벽을 극복할 수 있을 만큼 충분히 빨리 움직이고 전이상태에 들어가 반응한다. 따라서 반응은 일어나지만 속도는 아주 느린 것을 알 수 있다. 이 시스템을 가열하면, 모든 반응물 분자가 더 빠르게 움직여 더 많은 운동에너지를 갖고, 반응속도는 더 빨라진다. 하지만 분자의 평균 운동에너지를 증가시키기 위해 가열하는 방법은 생물계에 사용될 수 없다. 이러한 비특이적인 접근방식은 모든 화학반응을 가속하며 이 중에 단백질의 변성과 같은 파괴적인 반응도 일어난다. 생물계에서 반응을 가속하는 효과적인 방법은 반응물을 서로 가까이 가져가기 때문에 에너지 장벽을 낮추는 것이다. 세포에서는 효소가 이 역할을 맡고 있다. 촉매는 화학반응의 속도를 증가시킨다. 대부분의 비 생물학적 촉매는 비특이적이다. 백금 가루를 예로 들었을 때, 수소 분자가 반응물인 거의 모든 반응을 촉진하지만 반대로 대부분의 생물학적 촉매는 매우 특이적이다. 효소는 보통 하나 또는 아주 유사한 소수의 반응물과 결합하여 특이적인 생성물을 만든다. 효소 촉매반응에서 반응물은 기질이라고 부른다. 기질 분자는 활성부위라는 효소 단백질의 특정 부위에 결합하는데 이곳에서 촉매 반응이 일어난다. 특정한 반응만을 빠르게 하는 효소의 특이성은 활성부위의 정확한 3차원 모양과 구조에 기인하며, 매우 좁은 범위의 기질만이 그 부위에 맞을 수 있다. 모양, 작용기, 성질이 서로 다른 분자들은 활성부위에 정확히 맞지 않으며 결하지 못한다. 이러한 특이성은 막 수송단백질, 수용체 단백질이 특정 리간드와 형성하는 특이적 결합과 비교할 수 있다.
산화환원효소는 분자 간에, 특히 에너지 대사에서 전자를 전달하며 전달효소는 작용기를 분자 사이에서 전달한다. 가수분해효소는 물을 첨가하며 분자의 공유결합을 끊는다. 분해효소는 다양한 화학결합을 가수분해와 산화를 제외한 다른 방법으로 분해하며, 흔히 새로운 이중결합이나 고리구조를 만들어낸다. 이성질화효소는 한 분자 내에서 작용기의 위치를 이동시켜 원자들은 같지만 서로 다르게 결합한 이성질체를 만든다. 연결효소는 두 분자를 하나로 연결한다. 기질이 효소의 활성부위에 결합하면 효소기질 복합체가 생성된다. 복합체의 연결을 유지하는 화학적 힘에는 수소결합, 전기적 인력, 일시적인 공유결합이 포함된다. 효소기질 복합체는 반응을 마친 후 생성물과 효소로 분리된다.
| E + S -> ES -> E + P |
여기서 E는 효소, S는 기질, P는 생성물, ES는 효소기질 복합체이다. 반응이 끝나고 유리된 효소는 화학적 형태가 반응 전과 같다. 효소는 기질과 결합하고 있는 동안에 화학적으로 변할 수 있지만, 반응이 끝나면 처음의 형태로 회복되어 다른 기질과 결합할 준비를 한다. 효소와 기질은 수용체와 리간드의 결합과 유사하다. 이 경우에 수용체와 리간드의 친화도를 해리상수로 나타냈다. 이를 통해 효소와 기질의 결합은 어느 정도 가역적이고 기질이 반응이 일어나기 전에 떨어져 나올 수 있다. 그러나 많은 효소 촉매 반응에서는 효소기질 복합체의 수명이 짧기 때문에 생성물이 빨리 만들어지게 되면서 반응이 일어난다.
'생명과학' 카테고리의 다른 글
| 13. 효소(3) (0) | 2022.11.30 |
|---|---|
| 13. 효소(2) (0) | 2022.11.29 |
| 12. 에너지, 물질대사(2) (0) | 2022.11.25 |
| 12. 에너지, 물질대사 (0) | 2022.11.24 |
| 11. 신호(4) (0) | 2022.11.23 |




댓글